信息编译:NK细胞中的人类收费受体8(TLR8):对癌症免疫治疗的影响
发表人:admin 发表时间:2023/7/18原文
Human toll-like receptor 8 (TLR8) in NK cells: implication for cancer immunotherapy
https://doi.org/10.1016/j.imlet.2023.07.003
NK细胞中的人类收费受体8(TLR8):对癌症免疫治疗的影响
摘要
Toll样受体(TLR)是同源或异二聚体蛋白质,其结构和功能在抗原呈现细胞(APC)中被广泛描述,如树突状细胞(DC)。最近,在NK细胞中也描述了TLRs在对抗病原体中的表达和作用。它们的激活和功能特性可以由TLR的激动剂直接和间接地调节。特别是CD56bright NK细胞子集,即组织和肿瘤微环境(TME)中最丰富的NK细胞子集,主要由内体TLR8特有的激动剂激活,在促炎细胞因子产生、增殖和细胞毒性方面。DC和NK之间的相互作用取决于细胞间接触和细胞因子等可溶性因素,促进DC成熟和NK细胞激活。基于这一概念,基于TLR的免疫疗法旨在激活NK-DC轴,可以通过诱导促炎表型来调节TME,从而提高DC向T细胞呈现肿瘤相关抗原的能力,以及NK细胞对肿瘤细胞的细胞毒性。在这次小型审查中,我们报告了关于人类NK细胞的TLRs的最新文献数据,以及它们作为辅助剂在癌症疫苗或肿瘤联合免疫治疗中的应用。
先天免疫的细胞通过其模式识别受体(PRR)识别微生物相关或病原体相关的分子模式(MAMPs/PAMPs),包括NOD样受体(NLRs)、C型凝集素受体(CLRs)、RIG-I样受体(RLRs)和Toll样受体(TLRs)[1,2]。与抗原呈现细胞(APC)类似,TLR介导的信号通路也是自然杀手(NK)细胞中对细菌、病毒和真菌病原体的第一道防线[3],[4],[5]。此外,TLRs被用于促进NK细胞和APC之间的串扰。特别是通过TLR7/8激活的浆细胞样树突状细胞(pDC),促进I型干扰素(IFN)[6,7]的释放,诱导CD69的表达增加,并增强NK细胞的细胞溶解活性[8];另一方面,激活的NK细胞在产生TNF-α时刺激DC成熟[8]。
本迷你评论报告了关于TLRs在人类NK细胞上的表达和功能及其在癌症免疫治疗中的应用的最新文献数据。它将特别关注在癌症疫苗或联合肿瘤免疫治疗中用作佐剂的TLR8激动剂,旨在重新激活肿瘤内功能障碍的NK细胞[9]。
1.Toll样受体:特征和功能
TLRs是免疫细胞细胞表面和内体膜上表达的最明确的PRR[10,11]。在细胞表面表达的人类TLR是TLR1、2、4、5、6、10,而内体是TLR3、7、8、9[12]。TLR识别保守的PAMP,它们作为TLR激动剂/配体(TLRL),在时间、结合亲和力和相互作用的构象位点方面存在差异[13,14]。除了PAMP,一些内源性成分,如纤维蛋白原、热休克蛋白、RNA和DNA,也通过TLRs提供信号[14,15]。TLR不仅在先天免疫细胞上表达,而且在一些适应性免疫细胞(如Treg和激活T细胞)上表达,因此广泛促进了对病原体的免疫反应[15]。TLR是I型跨膜蛋白,其外结构域含有富含亮氨酸的重复(LRRs),介导PAMP识别、跨膜结构域和下游信号转导所需的∼200 aa细胞内托尔白细胞介素1(IL-1)受体(TIR)结构域的保守区域[1,16]。
TLR是同源或异二聚体蛋白质。特别是,TLR8存在于内体膜上,无论是作为同源二聚体还是与TLR7[17]联合的杂二聚体。TLR8以及TLR7结合来自RNA病毒(如水泡性口炎、甲型流感和HIV)和咪唑喹啉衍生物的单链RNA(ssRNA),或鸟嘌啶类似物作为Loxoribine[12,18]。虽然人类TLR7识别富含GU的ssRNA序列,但人类TLR8由于其能够形成配体特异性二级结构,可以结合富含AU和GU的序列。值得注意的是,TLR的刺激可能会调节其他内体TLR的表达。例如,TLR8触发导致TLR7和TLR9的下调,以及单核细胞/巨噬细胞中TLR2的增加[19]。这一观察结果在Tlr8−/−小鼠中重现,其中TLR8的缺失导致TLR7和干扰素刺激基因的表达水平更高[20]。
所有TLR的细胞内信号传导始于骨髓分化初级反应蛋白88-(MyD88-)的磷酸化;唯一的例外是TLR3,它刺激含有TIR结构域的适配器诱导干扰素-β(TRIF)依赖性途径[1,16]。这两种途径都会导致NF-kB、AP1、CREB、IRF3/7等转录因子的激活,这反过来又促进了I型和III型干扰素(IFN)、炎症细胞因子/趋化因子、共刺激和粘附分子以及抗菌介质的基因转录[3]。
2.TLR的表达及其在NK细胞激活中的作用
TLRs(特别是内体TLRs)在人类NK细胞中的表达受以下因素的影响:i.不同供体中新鲜分离的TLR+ NK细胞的可变激活程度,ii。DC-NK细胞相互作用由不同的表面和可溶性信号(细胞因子)介导,这反过来可能有利于或损害NK细胞中内体TLR的表达和触发,iii.在触发其中一个受体后交叉调节此类受体,iv.DAMPs和miRNA与一些TLRs(主要是TLR4和TLR7/8)的表达和激活的干扰[21],[22],[23],[24],[25]。
大多数报告同意,NK细胞表达功能性TLR1 [26]、TLR2 [24]、TLR3[22]、TLR4 [27]、TLR5 [26]、TLR7/8 [28,29]和TLR9 [30],无论其激活状态如何。mRNA分析表明,在纯化NK细胞中,TLR1表达最多,其次是中等水平的TLR2、TLR3、TLR5和TLR6,以及其他内体TLR水平较低[26,30]。然而,在两个主要的NK细胞子集中,不同的TLRs和活性的表达存在不确定性:CD56dimCD16+细胞在外周血中占主导地位(>90%),专门具有细胞毒性活性,CD56brightCD16-细胞的细胞溶解性较低,产生高水平的细胞因子,在外周血中代表性较低(<10%),而它们在组织中很普遍(例如淋巴结的T细胞区域)和肿瘤微环境(TME)[31]。我们小组最近的一项研究发现,内体TLR在mRNA和蛋白质水平的CD56brightCD16−和CD56dimCD16+ NK细胞亚群中一致表达,[32]
对TLRL的反应在体外活化和新分离的NK细胞中都发生,其中次优剂量的炎症细胞因子,主要是IL-2和IL-12,会产生更多的TLR介导的激活。特别是,内体TLR的激动剂可以通过辅助细胞、细胞因子或细胞间接触直接或间接激活NK细胞功能[23]。最近,我们提供了确凿的证据,表明静止的NK细胞可以在共刺激下被内体TLRL激活,如次优剂量的细胞因子,包括IL-2、IL-12、IL-15、IL-18(单独或组合)[23]。事实上,一些研究表明,NK细胞在体外被DC衍生的IL-12和T细胞衍生的IL-2激活[22,29,30,33,34]。
总而言之,这些数据强化了TLR参与的直接和间接影响促进了DC和NK细胞之间相互作用的概念,而这反过来又可能影响下游其他先天和适应性免疫细胞。
清晰的数据表明,尽管NK细胞可以被内体TLR的一些激动剂直接激活,但与DC的串扰和细胞因子微环境对激活NK细胞效应功能至关重要。
3.NK细胞子集主要通过TLR8激活
当与其他内体TLRL作为TLR3L(Poly I:C)和TLR9L(ODN2395)相比,TLR7/8L(R848)最有效地诱导NK细胞激活。事实上,在R848刺激下,CD69+和CD25+ NK细胞的比例大幅增加,在Poly I:C刺激下显著减少,在ODN2395刺激下则没有。此外,仅使用Resiquimod改善了细胞毒性活性和细胞因子生产(IFN-γ、TNF-α和GM-CSF)。重要的是,R848是唯一能够通过CD56brightCD16−激活和诱导IFN-γ生产的内体TLRL,在较小程度上能够通过CD56dimCD16+ NK细胞子集激活和诱导IFN-γ的内体TLRL,而Poly I:C仅弱地触发CD56dimCD16+子集。值得注意的是,R848没有诱导NK细胞上CD57表达的增加,这表明诱导其成熟的能力是边缘的。除了诱导活化标志物外,R848,而不是其他TLRL,还诱导了CD56brightCD16− NK细胞增殖(峰值为4天)和细胞毒性,并上调CD107a、Perforin和Granzymes的表达[32]。
之前的报告强调了不同TLR7/8激动剂(包括R848)刺激单核细胞/巨噬细胞、DC和NK细胞的能力;我们最近的发现表明,R848完全通过TLR8触发NK细胞[32]。来自几份报告的数据将支持这一观点,特别是:i.TLR8,但不是TLR7,在NK细胞中以二聚体(活性)形式表达,可能受到DC驱动的细胞因子的青睐[35],ii. NK细胞在不同的刺激下产生的IFN-γ是TLR8表达的强大诱导剂(以自分泌方式)[36],iii.来自NK、肿瘤和肿瘤环境细胞的外切体中包含的miRNA主要结合TLR8,影响NK细胞功能[37,38],iv. CD56brightCD16− NK细胞的许多功能由TLR8(TL8-506)特异性激动剂上调,但不是TLR7(Imiquimod,Loxoribin和改良8-羟基腺嘌嘌嘌呤)[32]。值得注意的是,与NK细胞类似,TLR8,但不是TLR7,最近被证明在其他先天细胞中具有功能活性,如中性粒细胞[39,40]。需要强调的是,TLR8是唯一能够通过核苷修饰来区分宿主RNA并在微生物RNA进入细胞时激活其信号通路的TLR[41]。此外,重要的是要强调,TLR8识别来自可存活微生物的微生物结构[42],以及具有抗病毒功能的聚(A)/T序列和小化学分子[43]。
4.癌症免疫疗法:针对NK细胞中的TLR8
临床前和临床研究提供了证据,表明TLR7和TLR8参与后的下游炎症反应,对癌症和病毒感染的治疗及其作为疫苗佐剂的作用具有初步疗效。这解释了为什么在过去十年中,新型TLR7和TLR8小分子激动剂的优化取得了重大进展,拥有70多项新专利。目前正在对这些新型化合物进行分析,以评估其所需的免疫反应能力,提高其安全性,并在联合疗法中与检查点抑制剂协同作用[44]。
当在肿瘤内给药时,TLR8激动剂除了NK细胞激活外,还促进NK和巨噬细胞之间的相互作用,M2到M1的转移,导致MHC II类表达增加,并让天真的CD4+ T细胞分化为1型配置文件[45]。此外,TLR8激动剂通过TLR8-MyD88-IRAK4信号通路介导人类Treg细胞抑制功能的逆转,并有助于滤泡辅助T细胞分化[9,42]。
针对DC和NK细胞之间的串扰可能是一种有希望的治疗感染和癌症的方法。然而,众所周知,系统输送的TLRL的临床疗效受到其溶解度、全身毒性和可能诱导自身免疫的限制[46,47]。为了克服在癌症治疗中使用TLR7/8激动剂的这些局限性,开发了基于生物材料的药物输送系统。这些设备可以直接在肿瘤部位使用,并被动地积累在淋巴组织中。此外,它们可能由环境刺激触发,并可能针对特定的细胞群体。此外,最近的研究还回顾了TLR7/8激动剂与其他疗法共同交付的潜在好处,特别是检查点抑制剂、实验性癌症疫苗和化疗,从而产生相关的抗癌作用[48]。
在小鼠模型中,局部输注的内体TLR激动剂增强了肿瘤部位免疫细胞的招募和激活,具有更有效的NK细胞活性,T细胞反应的1型概况和检查点抑制剂的疗效改善[49]。特别是,在急性骨髓性白血病模型中,TLR7/8激动剂被发现可以延缓肿瘤生长,甚至诱导肿瘤消退[50,51]。最近的研究还表明,一些新型TLR7/8激动剂诱导强大的促炎细胞因子分泌,并在体外增强NK细胞介导的ADCC,并在两种不同的体内肿瘤小鼠模型中增强了单克隆抗体的功效[52]。
根据这些数据,用内体TLRL预处理NK细胞,或用这些分子进行肿瘤内(IT)治疗,可能确实代表了实体肿瘤治疗的新的潜在策略[53]。此外,皮肤应用Imiquimod(TLR7激动剂)或Resiquimod(TLR7/8激动剂)来治疗人类皮肤肿瘤,主要诱导NK细胞的局部激活,极大地限制了全身受累和不必要的副作用[54,55]。值得注意的是,这些发现凸显了渗入TME的NK细胞的TLR8参与的潜在作用,作为肿瘤免疫治疗的新策略。TLR8激动剂在CD56brightCD16- NK细胞上的主要活性,在组织和肿瘤病变中占主导地位,使TLR8激动剂的局部输注比癌症治疗的潜在候选者更多。在这方面,我们最近的数据显示,TLR8靶向改善了从转移性卵巢癌(主要由CD56brightCD16-NK细胞代表)患者的推力液中提取的NK细胞的IFN-γ生产和细胞毒性活性[32]。在这个肿瘤中,TLR8信号激活NK细胞,而NK细胞反过来可能产生细胞因子和趋化因子,通过诱导其他效应细胞的增殖和招募来增强对NK细胞的影响[32]。在实体肿瘤的TME中,据报道,TLR8激动剂可以诱导肿瘤细胞凋亡,有利于髓源性抑制细胞的成熟(和功能丧失)[56]并防止T细胞衰老/耗尽[57]。此外,据报道,TLR8激动剂对卵巢癌细胞微环境中的CD4+ T调节细胞产生代谢抑制作用[58]。最后,在人类中,TLR8激动剂在不同转移性实体肿瘤患者的临床Ib-II期试验中进行了局部检测[49,59,60]。
5.结束语
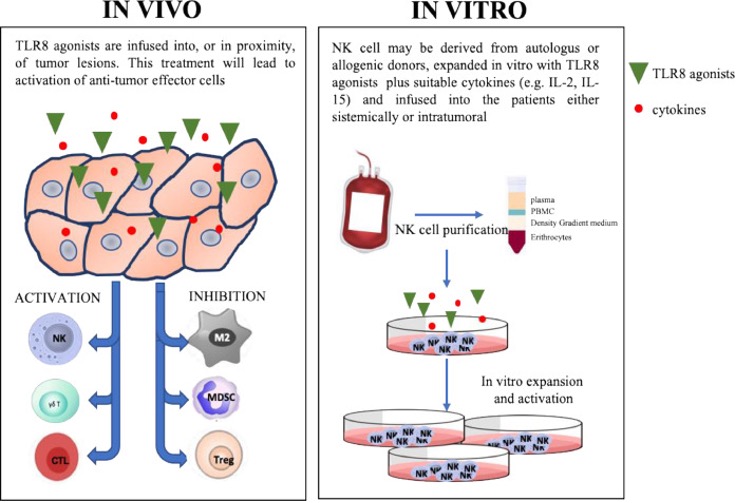
总之,最近,不同的结果表明,在一些体内模型中,TLR8激动剂的作用始终是由激活的NK细胞介导的[61,62]。未来的研究工作应致力于确定由此类激动剂激活的NK细胞与TME中的其他细胞之间发生哪些相互作用,同时关注药物安全、效率和特异性[63]。TLR8介导的卵巢癌患者腹水中NK细胞反应性抢救的发现,也可以作为新的体外分析,以确定哪些患者可以通过在腹膜腔中注入TLR8激动剂(作为肿瘤疫苗或联合化疗或免疫疗法的佐剂)和/或用TLR8配体外扩张的自体或异体性NK细胞的收养转移获得相关益处(图。1)。
图1.TLR8激动剂在肿瘤免疫治疗中的潜在机制。
医院名称:广西科技大学第一附属医院
医院地址:柳州市柳北区跃进路124号
联系方式:0772-2829502(科教科)
网站版权信息:Copyright广西科技大学第一附属医院 AllRights Reserved
